El Carbono
La química orgánica estudia los compuestos que contienen carbono. El carbono puede encontrarse en diferentes formas alotrópicas, como carbono amorfo, cristalino, grafito, diamante, fullerenos, nanotubos y nanoespumas.El carbono posee la siguiente configuración electronica: 1s2 2s2 2px1 2py1. Sin embargo, los electrones del Carbono se redistribuyen de la siguiente manera: 1s2 2s1 2px1 2py1 2pz1, quedando con cuatro electrones desapareados y como tetravalencia. Según esta nueva configuración, se establecen 4 enlaces covalentes, pero esto no explica por que los enlaces C-H en el metano son idénticos, aún cuando los orbitales participantes 2s, 2px, 2py, 2pz son distintos.
Para explicarlo, se establecen los orbitales híbridos, que son una combinación de orbitales 2s y 2p, que resultan ser identicos entre sí.
De esta manera el C tiene tres tipos de hibridación:
a) 4 enlaces simples (sp3)
b) 2 enlaces simples y 1 enlace doble (sp2)
c) 1 enlace simple y un enlace triple (sp)
--------------------------------------------------------------
Enlace sp3

Enlaces sigma: se forma cuando uno de los electrones del orbital 2s se excita y se desplaza al orbital 2pz, presentando la configuración de estado excitado: 1s2 2s1 2px1 2py1 2pz1
Se hibrida entonces el orbital 2s con los tres orbitales 2p, formando cuatro nuevos orbitales híbridos, llamados sp3 tetraédrica. De esta manera el carbono se presenta como tetravalente, con enlaces sigma, entre el carbono y cada hidrógeno (para el caso CH4).
--------------------------------------------------------------
Enlace sp2
Enlace pi: el átomo de carbono puede formar enlaces dobles o triples, llamados insaturaciones.
Los enlaces dobles o pi presentan una hibridación entre el orbital 2s y dos orbitales p, según la siguiente configuración: 1s2 (2sp2)1 (2sp2)1 (2sp2)1 2pz1. Los orbitales verticales forman enlaces pi, los orbitales horizontales forman enlaces sigma.
--------------------------------------------------------------
Enlace sp
Enlaces triples: el carbono hibrida su orbital 2s con un orbital p, quedando dos sin hibridarse, presentando la configuración: 1s2 (2sp1) (2sp1) 2py1 2pz1. Solo los orbitales paralelos forman enlaces pi, y los que se enfrentan horizontalmente forman enlace sigma (caso C2H6).
--------------------------------------------------------------
Hidrocarburos
Compuestos formados por carbono e hidrógeno. Son insolubles y menos densos que el agua. Son combustibles, explosivos. Se clasifican en:
1. Alifáticos
1.1 Saturados (Alcanos)
1.2 Insaturados (Alquenos y alquinos)
2. Aliciclicos
2.1 Cicloalcanos
2.2 Cicloalquenos
2.3 Cicloalquinos
3. Aromaticos
3.1 Homocíclicos (Bencenicos, Naftalenicos y Antracenicos)
3.2 Heterocíclicos (1 heteroátomo + anillo; 2 anillos distintos)
Nomenclatura IUPAC (International union of pure and applied chemistry)
Número de carbonos y prefijos:
1C = meta
2C = eta
3C = propa
4C = buta
5C = penta
6C = hexa
7C = hepta
8C = Octa
9C = Nona
10C = Deca
11C = undeca
20C = eicosa
--------------------------------------------------------------
Alcanos o Parafinas:
Usa el sufijo ano y su formula general es CnH2n+2
1C (metano); 2C (etano); 3C (propano); 4C (butano); 5C (pentano); 6C (hexano); 7C (Heptano); 8C (Octano); 9C (nonano); 10C (decano).
Metano: CH4 ; Etano: C2H6 ; Propano: C3H8; Butano C4H10; Pentano C5H12;.....
Se caarcterizan por ser no polares, insolubles en agua y miscibles entre sí. Sus temparaturas de ebullición y fusión aumentan en proporción al número de carbonos.
De 1 a 4 C son gases; de 5 a 16 C son líquidos; de 17 en adelante son sólidos.
Para producir alcanos saturados se puede utilizar la hidrogenación de alquenos, usando pt, pd o Ni como catalizador.
Las reacciones más comunes de los alcanos son:
a) Combustión: el Hidrocarburo reacciona con el oxígeno (O2), convirtiendose en CO2 y H2O.
ejemplo: 2CH4 + 7O2 --------- 2CO2 + 4 H2O + Energía.
b) Pirolisis: Producida por la acción de altas temperaturas sobre los alcanos en ausencia de oxígeno, provocando la ruptura de enlaces C-C y C-H, lo que da origen a radicales más pequeños.
Ej. CH3CH2CH2CH2CH3 ------------CH3 + CH3CH2CH2CH2-
En la pirolosis también puede ocurrir un desproporcionamiento, proceso en el que uno de los radicales transfiere un atomo de hidrógeno al otro radical para producir un alcano y un alqueno.
CH3CH2- + CH3CH2CH2- --------CH3CH3 + CH3CH=CH2
c) Halogenación: proceso en el cual se reemplaza en el hidrocarburo un hidrógeno por un átomo de halógeno, produciendo un halogenuro de alquilo:
Ej. CH4 + Cl ------------ CH3Cl + HCl
--------------------------------------------------------------
Alquenos (Olefinas)

Hidrocarburos con dobles enlaces entre C y C. Su formula general es CnH2n y su terminación característica es eno
2C (eteno); 3C (propeno); 4C (buteno); 5C (penteno); 6C (hexeno); 7C (hepteno); 8C (octeno); 9C (noneno); 10 C (deceno).
Se caracteriza por tener una alta densidad electrónica en su enlace covalente doble, lo que le otorga una alta reactividad.
Reactividad de Alquenos:
Las reacciones más importantes son las de adición, en las que se produce la ruptura del doble enlace para la introducción de sustituyentes y donde intervienen un agente simétrico y uno asimétrico.
a) Simétrico: CH2=CH2 + Cl2 ------------ CH2Cl- CH2Cl
b) Asimétrico: CH2=CH2 + HX ------------CH3-CH2Cl
--------------------------------------------------------------
Alquinos (acetilenos)

Hidrocarburos con triple enlaces. Obedecen a la fórmula CnH2n-2. Su terminación es ino.
2C (etino); 3C (propino); 4C (butino); 5C (pentino); 6C (hexino); 7C (heptino); 8C (octino); 9C (nonino); 10C (decino).
a) Hidrogenación: Si el agente simétrico es H2 se forma un alcano
b) Halogenación: Si el agente simetrico es Cl2.
Reactividad en Alquinos:
El procedimiento más común es la deshidrogenación de halogenuros de alquilo.
a) Simétrico: CH=_CH + H2 -------------- CH2=CH2
b) Asimétrico: CH=_CH + HCl -----------CH2=CHCl
--------------------------------------------------------------
Hidrocarburos cíclicos
Hidrocarburos cíclicos: Son cadenas cerradas que se dividen en Aliciclicos (cicloalcanos, cicloalquenos y cicloaquinos) y Aromáticos (anillos aromaticos e insaturados). Existen compuestos que tienen varios anillos unidos, los policíclicos.
Cicloalcanos: ciclo formado por enlaces simples. El más simple de todos es el ciclopropano (3C) o en la foto el ciclohexano (6C)
Cicloalquenos: Hidrocarburos cíclicos con enlaces doble. El más simple es el ciclopropeno (3C) o el ciclohexeno (6C):
Cicloalquinos: presentan triples enlaces. El más simple es el ciclopropino (3C), en la foto:
Hidrocarburos aromáticos:Ciclos que poseen varios enlaces dobles separados por enlaces simples. Muchos de estos compuestos presentan un olor agradable, pero posteriormente se descubrieron otros que son inodoros o de olor desagradable. Se derivan del benceno. August Kekulé (1829-1896) caracterizó por primera vez la estructura. A Kekulé se le considera el fundador de la química orgánica.
Radicales unidos al benceno:
Metil (CH3-)
Etil (CH3CH2-)
Propil (CH3CH2CH2-)
Butil (CH3CH2CH2CH2-)
etc.
Posiciones para identificar la ubicación específica de los radicales en el benceno:
Orto: indica la numeración 1 y 2
Meta: señala la numeración 1 y 3
Para: señala la numeración 1 y 4
Reactividad en Aromaticos:
a) Hidrogenación
b) Halogenación
--------------------------------------------------------------
Nomenclatura de cadenas ramificadas
En la foto: 4-etil, 2,2-dimetil, hexano
Reglas para asignar un nombre:
1. se elige la cadena carbonada más larga
2. Si el compuesto tiene enlaces dobles o triples, se escoge la cadena con la mayor cantidad de atomos de C posibles que congrege a estos enlaces.
3. Los compuestos que están afuera de la cadena principal son radicales o ramas laterales. Estas deben ser las más simples posibles.
4. Se enumera la cadena. Si es alcano, se da la numeración más baja posible al radical; y si es alqueno o alquino, a los enlaces respectivos, independientemente de la ubicación del radical.
5. En la numeración se le da preferencia a los enlaces triples y luego a los enlaces dobles
6. Se da el nombre a la cadena considerando el siguiente orden: ubicación de los radicales, nombre del radical en orden alfabetico, nombre de la cadena principal.
Denominaciones de cadenas principales alcanos y nombre de sus radicales:
1C : Metano (CH4); metilo (-CH3)
2C : Etano (C2H6); etilo (-CH2-CH3)
3C : Propano (C3H8); propilo (-CH2-CH2-CH3)
4C : Butano (C4H10); butilo (-CH2-CH2-CH2-CH3)
5C : Pentano (C5H12); pentilo (-CH2-CH2-CH2-CH2-CH3)
6C : Hexano (C6H14);
7C : Heptano (C7H16);
8C : Octano (C8H18);
9C : Nonano (C9H20)
10C : Decano (C10H22)
--------------------------------------------------------------
Isomería
Los isomeros son compuestos que presentando el mismo número de átomos de cada clase en una molécula, tienen propiedades distintas.
Pueden clasificarse como:
1. Isomería Constitucional o estructural
a. de cadena: Poseen el mismo número de atomos, pero presentan ubicaciones espaciales distintas.
b. de posición: Compuestos que teniendo las mismas funciones químicas están enlazados a distintos átomos de carbono.
c. de función: Se presentan en compuestos que teniendo la misma formula molecular, poseen grupos funcionales distintos.
2. Estereoisomería
a. isomería óptica o enantiomería: Son aquellas moleculas que guardan entre sí una relación especular, es decir, no son superponibles el objeto y su imagen. Sometidos a luz polarizada en un plano girarán a la derecha (dextrogiro) y otro girará a la izquierda (levógiro).
b. isomería geométrica o diasteroisomería: Ambos poseen los mismos tipos de átomos, pero su disposición espacial esta girado uno respecto al otro. Cuando los grupos quimicos estan en el mismo lado se denomina Cis, cuando están en lados opuestos se denominan Trans.
--------------------------------------------------------------
Funciones Orgánicas
Un grupo funcional organico es un grupo de átomos que confiere a un compuesto propiedades particulares. Los grupos funcionales mas comunes son:
1. Acido carboxilico (R-COOH)
2. Ester (R-COO-R)
3. Amida (R-CO-R)
4. Aldehido (R-CHO)
5. Cetona (R-CO-R)
6. Alcohol (R-OH)
7. Amina (R-NH2)
8. Eter (R-O-R)
9. Haluros (R-X), (X = F, Cl, Br, I)
Haluros: se indica la posición y nombre del halógeno seguido del nombre de la cadena principal. Ej. 2-cloro-propano
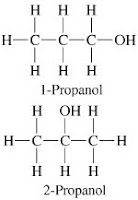
Alcoholes: Se indica la ubicación del grupo funcional seguido del nombre de la cadena con la terminación caracteristica OL. Ej. 1-propanol. Existen Alcoholes primarios (R-CH2-OH), Secundarios R-CH(OH)-CH2, terciarios R3-C(OH)
Eteres: se indican las cadenas carbonadas seguido del sufijo eter. Ej. Metil, propil-eter
Aldehido: se nombra la cadena con un numero determinado de carbonos y luego se termina con el sufijo AL. Ej. Butanal
Acidos carboxilicos: Se antepone Acido, luego el nombre de la cadena y se termina con el sufijo OICO. Ej. Acido etanoico.
Esteres: se reconoce el radical enlazado al carbono del grupo COO, al cual se le asigna la terminación ATO, seguido del nombre del radical enlazado al oxigeno del grupo COO con terminacion ilo. Ej. Etanoato de etilo
Amidas: se nombra la cadena carbonada y se agrega el sufijo amida. Ej. Etanamida. Existen amidas primarias (R1-CONH2), secundarias (R1-CO-NH-R2) y terciarias (R1-CO-N-R2).
Ej. Etanamida
Aminas: se nombra la cadena carbonada y se termina con sufijo amina. Ej. Etilamina. Existe una amina primaria (R-NH2), secundaria (R2-NH) y terciaria (R3-N).